中国科大揭示跨膜蛋白SIDT1调控人类核酸摄取的分子机制
日期:2024-04-07 浏览:2423次
RNA干扰是指由双链RNA诱导的基因沉默现象,不仅在细胞发育和抗病毒免疫等生物学过程中发挥着重要作用,而且被用作基因功能研究和疾病治疗的遗传工具。安德鲁·法厄与克雷格·梅洛因发现RNA干扰现象而荣获2006年诺贝尔生理及医学奖。
RNA干扰现象可在秀丽隐杆线虫全身及其后代中传播,被称为系统性RNA干扰。随后人们发现广泛表达的跨膜蛋白SID-1可作为通道将细胞外的双链RNA被动转运进细胞内,是系统性RNA干扰所必需的。人类SIDT1是SID-1的同源蛋白,同样可以促进细胞对双链RNA,包括小干扰RNA(siRNA)和微小RNA(microRNA)的摄取。然而,不论是SID-1介导的RNA干扰,还是SIDT1调控的双链RNA摄取,分子机制仍然未知。
近日,中国科学技术大学生命科学与医学部周丛照教授和陈宇星教授课题组,利用单颗粒冷冻电镜技术解析了人类SIDT1结合磷脂酸的复合物以及突变体E555Q的三维结构,整体分辨率分别为2.9 Å和2.4 Å。基于蛋白质结构分析和一系列生化分析,以及与姚雪彪教授课题组合作开展的细胞生物学实验,作者发现SIDT1是一种跨膜磷脂酶,并揭示其利用磷脂酶活性调控核酸摄取的分子机制。相关研究成果以“Human SIDT1 mediates dsRNA uptake via its phospholipase activity”为题于2023年11月06日在线发表在《Cell Research》上。
结构分析显示SIDT1呈现同源二聚体结构,每个亚基包含两个细胞外结构域(ECD1和ECD2)和一个由11股跨膜螺旋组成的跨膜结构域(TMD)。结构比对表明SIDT1属于跨膜水解酶CREST超家族,但与该超家族的其他成员相比,却以同源二聚体形式发挥作用,且具有相反的拓扑结构。SIDT1每个亚基的TMD中存在额外的分支状密度,可容纳一个磷脂酸分子、一个Zn2+离子和一个水分子。进一步的酶活实验和质谱分析表明SIDT1可水解磷脂酰胆碱,是一种Zn2+依赖的跨膜磷脂酶。随后,作者解析了SIDT1 E555Q突变体(酶活实验表明Glu555参与底物稳定)的结构,每个亚基的TMD外侧都结合一个棕榈酰油酰磷脂酰胆碱(POPC)分子,暗示了底物的侧向进入路径。最后,一系列的荧光摄取实验表明SIDT1可能通过其磷脂酶活性介导细胞摄取双链RNA、microRNA和双链DNA。该研究不仅丰富了人们对CREST和磷脂酶超家族的理解,而且鉴定了跨膜磷脂酶的一个新分支以及一种基于膜磷脂修剪的核酸摄取途径。此外,我们发现SID-1在人类中的另一同源蛋白SIDT2具有与SIDT1相当的磷脂酶活性。
中国科学技术大学周丛照教授、特任副研究员李琼、陈宇星教授和姚雪彪教授为该论文的共同通讯作者。在读博士生孙彩荣、已毕业博士徐达和博士后杨丰瑞为该论文的共同第一作者。冷冻电镜数据收集工作在中国科学技术大学冷冻电镜中心完成。该研究得到了中国科学院和合肥综合性国家科学中心大健康研究院项目的资助。
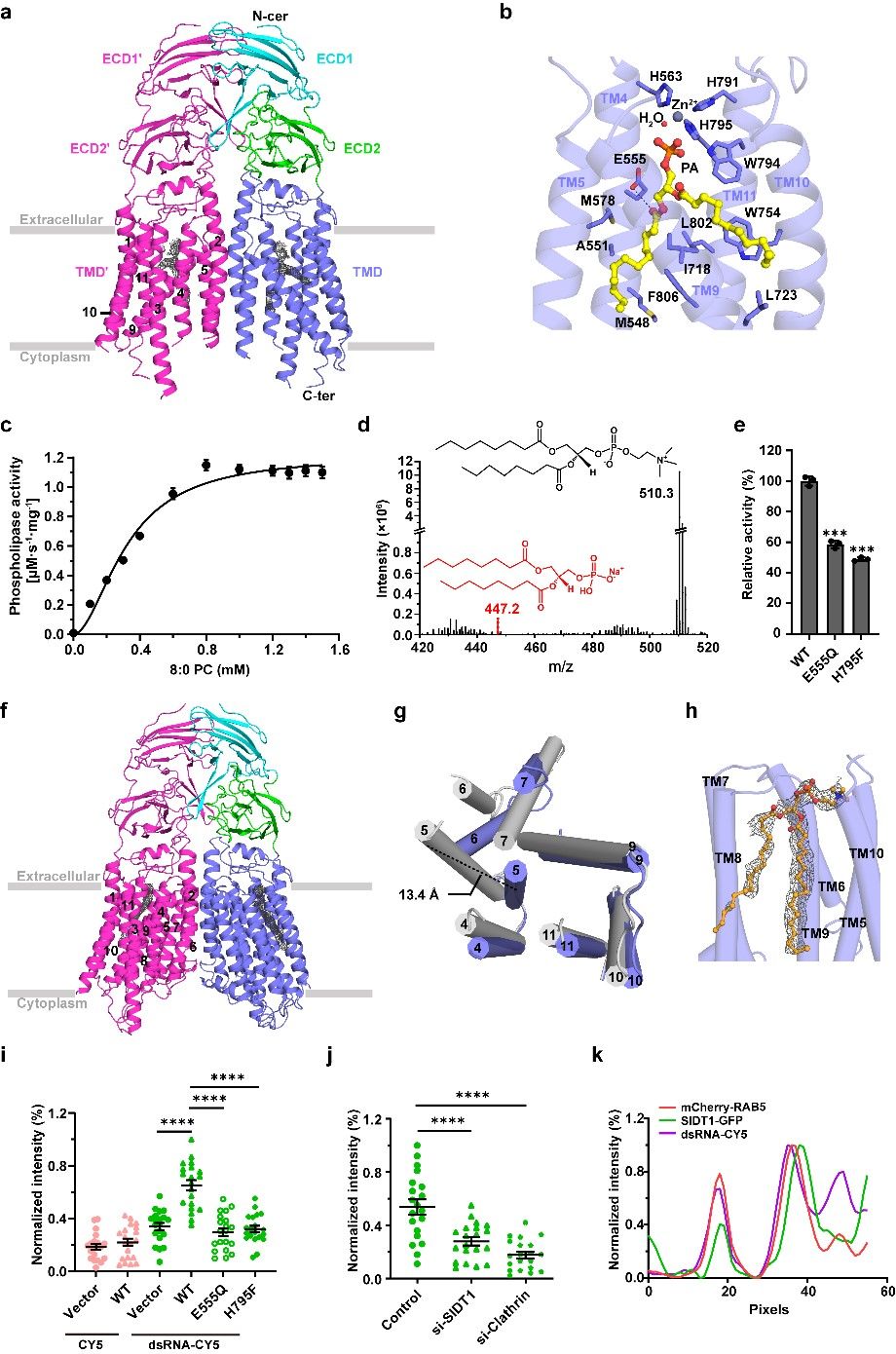
图:人类SIDT1的结构及其依赖磷脂酶活性介导的双链RNA摄取
原文链接:https://www.nature.com/articles/s41422-023-00889-x
(全文公开访问链接:https://rdcu.be/dqnnJ)