中国科大揭示信号蛋白PII调控蓝细菌碳氮平衡的新机制
日期:2024-04-07 浏览:4148次
中国科学技术大学生命科学与医学部周丛照教授和陈宇星教授课题组,利用单颗粒冷冻电镜技术解析了三种不同状态的硝酸盐/亚硝酸盐ABC转运蛋白NrtABCD(缩写为NRT)的三维结构,包括结合底物硝酸根NO3-、结合Mg2+-ATP以及结合信号蛋白PII的结构。基于结构和生化分析以及生理实验,作者阐明了一种新型ABC转运蛋白的底物识别模式和转运循环,以及PII如何通过响应不同的效应分子进而精细调控NRT转运活性的分子模型。相关研究成果以“Allosteric regulation of nitrate transporter NRT via the signaling protein PII”为题于2024年03月08日在线发表于《美国科学院院报PNAS》上。
碳氮代谢平衡是细胞正常生长和处于稳态的前提。蓝细菌作为一种古老的光合自养型原核生物,进化出由多种转录因子和信号蛋白调控的碳氮代谢网络。其中,作为目前分布最广泛的蛋白家族之一,信号转导蛋白PII响应细胞内代谢小分子和能量的变化,进而调控多种靶蛋白的活性,维持碳氮平衡。在铵盐缺乏的情况下,蓝细菌通过激活硝酸盐同化通路将硝酸盐/亚硝酸盐转运到细胞内并还原为铵,从而为其生长提供氮源。研究表明,PII能与硝酸盐/亚硝酸盐转运蛋白NRT互作进而调控硝酸盐同化通路的活性。NRT由5个蛋白亚基组成:一个底物结合蛋白(SBP)NrtA、两个相同的跨膜亚基(TMD)NrtB以及两个不同的核苷酸结合亚基(NBD)NrtC和NrtD,属于ABC转运蛋白家族的I型ABC importer。与经典ABC转运蛋白不同,其NrtC亚基的C端融合了一个与NrtA相似的调控结构域(CRD),被认为可能参与调控NRT的活性。目前,关于这种新型ABC转运蛋白的结构和转运机理,以及PII如何识别NRT进而调控蓝细菌碳氮平衡的分子机理仍不清楚。
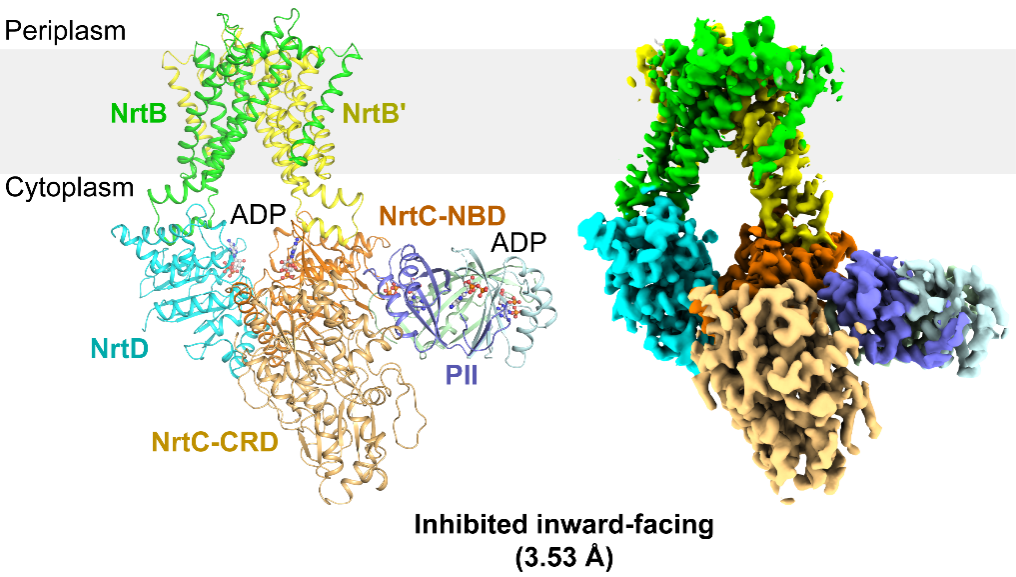
图1. NrtBCD-PII复合物的三维结构
作者解析了NrtBCD三种不同状态的三维结构。其中,结合底物硝酸根的NrtBCD-NO3-结构呈现向内开口(inward-facing)的构象,TMD中存在一个由结合硝酸根的疏水腔和富含精氨酸残基的亲水腔组成的连续的底物转运通道,负责底物的进入和释放。在结合Mg2+-ATP的NrtBCD-ATP结构中,ATP的结合引发NBD相互靠近,导致TMD发生构象变化,底物转运通道被封闭,形成封闭的向外开口(outward-facing occluded)的构象。NrtBCD-PII复合物结构采用了一种完全不对称的抑制型构象(图1)。与以前报道的PII通过T-loop结合靶蛋白的方式不同,NrtBCD-PII中的PII通过核心结构域中的T-loop基部、B-loop和C-loop等元件同时结合NrtC的NBD和CRD结构域,代表了一种新的相互作用模式。作者通过结构分析结合生化生理实验提出了PII通过调控NRT活性进而维持蓝细菌碳氮平衡的分子模型(图2):在高N/C比时,PII通过与NrtC直接结合进而与NRT形成复合物,将NRT锁定为抑制型向内开口(inhibited inward-facing)的构象,同时跨膜区的底物转运通道收窄,抑制了NRT的硝酸盐/亚硝酸盐转运活性。而在低N/C比时,细胞内的α-酮戊二酸(2-OG)累积,此时2-OG结合PII并导致PII发生构象变化,使其从NrtC上解离下来,NRT转运活性得以恢复,向胞内转运硝酸盐/亚硝酸盐,维持碳氮平衡。本研究不仅阐明了信号蛋白PII与靶蛋白的一种新型互作模式,还发现了一种非对称的ABC转运蛋白的调控模式,拓展了蓝细菌的碳氮代谢平衡调控网络。
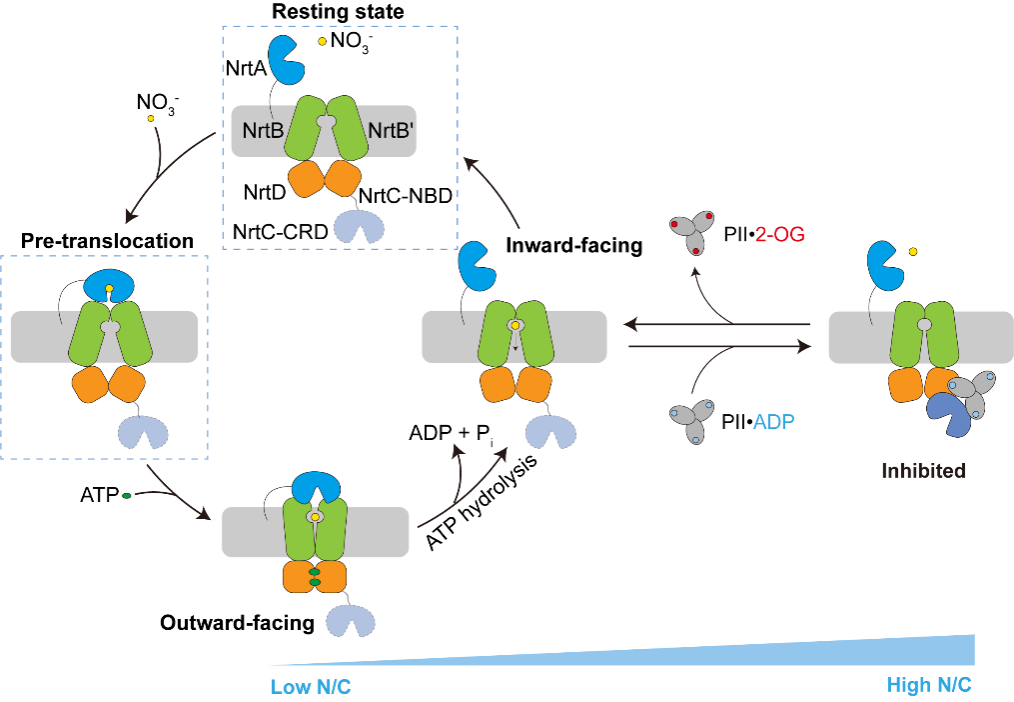
图2. PII调控NRT转运循环的模式图
中国科学技术大学周丛照教授、江永亮副教授和陈宇星教授为该论文的共同通讯作者,博士生李波为该论文的第一作者。冷冻电镜数据收集工作在中国科学技术大学冷冻电镜中心完成。该研究工作得到中国科学院、国家自然科学基金委、科技部和安徽省科技厅的资助。江永亮感谢中科院青促会(会员号:2020452)的支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2318320121